فرایند کشف دارو با ارائه مولکولهای جدید
دانشمندان اِم.آی.تی مدل یادگیری ماشینی اختراع کردهاند که در آن فرایند کشف دارو با ارائه مولکول های جدید، اتفاق میافتد و شرایطی را فراهم کردهاند تا بتوان مولکولهای پیشنهادی مدل را در آزمایشگاه ساخت.
تکنیک جدید هوش مصنوعی، صرفاً مولکولهای منتخبی را پیشنهاد میدهد که قابلیت ساخته شدن در آزمایشگاه را داشته باشند.
شرکتهای داروسازی از هوش مصنوعی برای تسهیل فرآیند کشف داروهای جدید استفاده میکنند. مدلهای یادگیری ماشینی مولکولهای جدیدی را پیشنهاد میکنند که دارای ویژگیهای منحصر به فردی برای مبارزه با بیماریهای خاص هستند و کاری را که برای انسانها چند ماه طول میکشد طی چند دقیقه انجام میدهند. فرایند کشف دارو با ارائه مولکول های جدید، دامنه بیماریهای درمان ناپذیر و خاص را نیز شامل میشود.
اما یک مانع بزرگ وجود دارد که اجازۀ پیشرفت به این سیستمها را نمیدهد: مدلها اغلب ساختارهای مولکولی جدیدی را پیشنهاد میکنند که تولید آنها در آزمایشگاه دشوار یا غیرممکن است. اگر داروسازها نتوانند مولکولها را بسازند، نمیتوانند قابلیت آن مولکول در مبارزه با بیماریها را ارزیابی کنند؛ بنابراین فرایند کشف دارو با ارائه مولکول های جدید، نیاز به بررسی بیشتر دارد.
رویکرد جدید محققان دانشگاه اِم.آی.تی به نحوی مدل یادگیری ماشینی را محدود میکند که صرفاً ساختارهای مولکولی قابل ساخت را پیشنهاد میکند. با استفاده از این روش، تضمین میشود مواد تشکیلدهندهی مولکولها قابل دسترس باشند و واکنشهای شیمیایی میان این مواد نیز از قوانین شیمی پیروی کنند.
آزمایشات نشان دادند که ساختارهای مولکولی پیشنهادی مدل مذکور، نمره بالاتری نسبت به روشهای دیگر دریافت کرده و قابلیت ساخت بهتری دارند. علاوه بر این، سیستم این پژوهشگران قادر است در عرض کمتر از یک ثانیه، شیوهای برای ساخت این مولکولها ارائه دهد؛ این در حالی است که روشهای دیگر که به طور جداگانه مولکولها را پیشنهاد و سپس قابلساخت بودن آنها را ارزیابی میکنند، همین امر را در عرض چند دقیقه انجام میدهند. با وجود میلیاردها مولکول قابل ساخت، این میزان زمان صرفهجویی شده در فضای جستوجو نیز همراه با آن افزایش مییابد.
کانر کولی، استادیار توسعۀ شغلی هِنری اِسلِزینگِر در دانشکدههای مهندسی شیمی، مهندسی برق و علوم کامپیوتر دانشگاه اِم.آی.تی و نویسندۀ ارشد این مقاله، میگوید: «این فرآیند نحوه تولید ساختارهای مولکولی جدید، توسط این مدلها را تغییر میدهد. بسیاری از این مدلها در پی تولید ساختارهای مولکولی جدید، اتم به اتم یا پیوند به پیوند هستند، اما در عوض، مدل ما مولکولهای جدید را جزء به جزء و واکنش به واکنش میسازد.»
ونهائو گِیو، دانشجوی مقطع کارشناسی ارشد، به عنوان نویسندۀ اصلی و روسیو مرکادو، دانشجوی مقطع فوق دکترا، کولی را در نگارش این مقاله همراهی کردهاند. این تحقیق اخیراً در کنفرانس بینالمللی بازنماییهای یادگیری ارائه شده است.
اجزاء سازنده
فرایند کشف دارو با ارائه مولکول های جدید، با مدل یادگیری ماشینی محقق خواهد شد؛ این مدل، برای اطمینان از ایجاد ساختار مولکولی، فرآیند ساخت یک مولکول را شبیهسازی میکند.
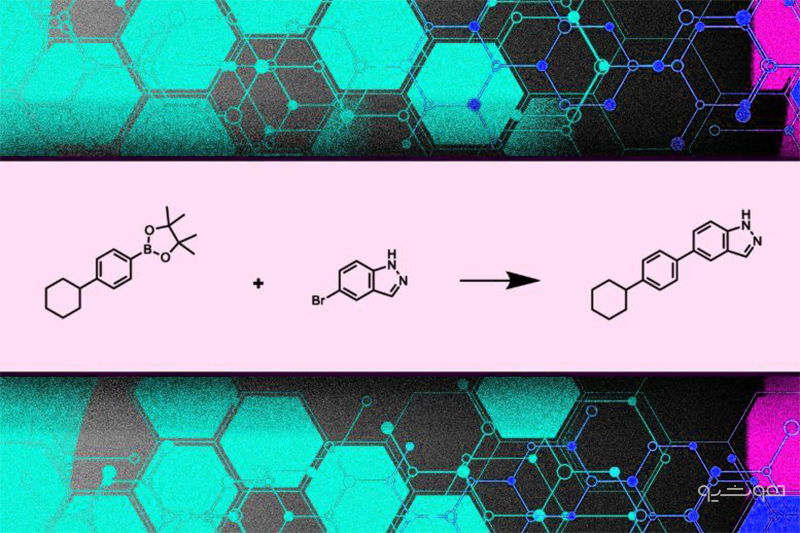
ورودی این مدل مجموعهای از اجزاء در دسترس شامل مواد شیمیایی در دسترس و فهرستی از واکنشهای شیمیایی قابل اجرا میباشد. قالب این واکنشهای شیمیایی به دست متخصصین ایجاد شده است. محققین تنها برخی مواد شیمایی و واکنشهای خاص را (به این قالبها) وارد میکنند و بدین ترتیب، با کنترل ورودی مدل، اندازه فضای جستوجو برای مولکولهای جدید را محدود میکنند.
مدل مذکور از ورودیها برای ساخت یک نمودار درختی استفاده میکند، بدین گونه که اجزای سازنده را انتخاب و با پیوند آنها از طریق واکنشهای شیمیایی، مولکول نهایی را میسازد. پیچیدگی مولکولها در هر مرحله به میزان مواد و واکنشهای شیمیایی بستگی دارد.
خروجی این مدل، ساختار مولکولی نهایی و نمودار درختی از مواد شیمیایی و واکنشهایی قابلساخت میباشد.
گِیو میگوید: «به جای طراحی خود ِمولکول نهایی، سلسله اقداماتی برای تولید آن مولکول طراحی میکنیم. بدین ترتیب میتوانیم کیفیت سازه را تضمین کنیم.»
محققان برای آموزش مدل، از یک ساختار مولکولی کامل و مجموعهای از اجزاء سازنده و واکنشهای شیمیایی به عنوان ورودی استفاده میکنند. اینگونه مدل میآموزد که برای ترکیب مولکولها نمودار درختی بسازد و پس از دیدن صدها هزار نمونه، یاد بگیرد که به تنهایی این شیوههای ساخت را ارائه دهد. بنابراین فرایند کشف دارو با ارائه مولکول های جدید، محقق خواهد شد.
بهینهسازی مولکول
از این مدل آموزش دیده میتوان برای بهینهسازی نیز استفاده نمود. محققان با توجه به اجزاء سازندۀ خاص و قالبهای واکنش شیمیایی، ویژگیهای خاصی را که میخواهند در یک مولکول نهایی به دست آورند، تعریف میکنند. سپس مدل، یک ساختار مولکولی قابلساخت را پیشنهاد میکند.
مرکادو میگوید: «بازتولید حجم بزرگی از مولکولها با چنین مجموعه کوچکی، بسیار جای شگفتی دارد. مدل برای جستوجوی اجزاء سازنده، به حجم زیادی از فضای شیمیایی قابل استفاده نیاز ندارد.»
محققین با طراحی آزمایشات مناسب، چگونگی بازسازی مولکولها در این مدل را ارزیابی کردند. مدل توانست 51 درصد از مولکولها را که تولید هر کدام از آنها به کمتر از یک ثانیه زمان نیاز داشت، بازتولید کند.
گِیو توضیح میدهد که تکنیک به کار رفته در این مدل سریعتر از روشهای دیگر عمل میکند، زیرا این مدل در هر گام، تمام گزینهها را برای هر قدم در نمودار درختی جستوجو نمیکند. این تکنیک مجموعهای مشخص از مواد شیمیایی و واکنشها، برای بهکارگیری آنها دارد.
پژوهشگران از مدل خود برای ارائۀ مولکولهایی با ویژگیهای خاص استفاده کردند؛ بدین ترتیب، روش آنها توانست در قیاس با سایر روشها، ساختارهای مولکولی با کیفیتتر با پیوندهایی مهمتر تولید کند. این بدان معنا بود که مولکولها بهتر میتوانند به پروتئینها بچسبند و مانع از فعالیتهایی خاص مانند تکثیر ویروس شوند.
به عنوان مثال، مدل این پژوهشگران هنگام ارائۀ مولکولی که بتواند به SARS-Cov-2 بچسبد، چندین ساختار مولکولی را پیشنهاد کرد که نسبت به مهارکنندههای موجود، بهتر میتوانستند به پروتئینهای ویروسی متصل شوند. با این حال، همانطور که نویسندگان این مقاله اذعان میکنند، این مطالب پیشبینیهای محاسباتی بیش نیستند.
گِیو میگوید: «بیماریهای زیادی برای مقابله با آنها وجود دارد. امیدوارم روش ما بتواند این روند را تسریع بخشد تا مجبور نباشیم هر بار میلیاردها مولکول را برای یک بیماری خاص غربال کنیم. در عوض، قصد ما صرفاً این است که ویژگیهای دلخواه خود را مشخص کنیم و بدینگونه، روند یافتن داروی مورد نظر را تسریع کنیم.» بنابراین فرایند کشف دارو با ارائه مولکول های جدید، نیاز به غربالگری و محدودسازی ملکولها دارد.
مرکادو میافزاید: «این مدل میتواند روال پردازشی موجود، برای کشف دارو را نیز بهبود بخشد. اگر شرکتی، مولکول خاصی را با خواص مطلوب شناسایی کرده است اما توان تولید آن را ندارد، میتواند از این مدل برای ارائۀ مولکولهای قابلساخت مشابه آن استفاده کند.
اکنون که این گروه از پژوهشگران، کارآمدی رویکرد خود را نشان دادهاند، قصد دارند عملکرد مدل را با بهبود قالبهای واکنش شیمیایی افزایش دهند. این پژوهشگران میتوانند با قالبهای اضافی، آزمایشهای بیشتری را روی بیماریهای خاص مورد نظر انجام دهند و در نهایت، این مدل را در فرآیند کشف دارو به کار گیرند.
ماروین سگلر، سرپرست گروه پژوهشی کشف دارو با یادگیری ماشینی شرکت مایکروسافت در دانشگاه کِیمبریج (بریتانیا) که نقشی در نگارش این مقاله ندارد، میگوید: «در حالت ایدهآل، به الگوریتمهایی نیاز داریم که به طور خودکار مولکولها را طراحی و همزمان و سریعاً، نمودار درختی سازه را ارائه کنند. این رویکرد هوشمندانۀ پروفسور کولی و گروه وی، یک گام بزرگ برای مقابله با این مشکل است. هر چند قبلاً کارهایی برای اثبات مفهوم طراحی مولکول از طریق تولید نمودار درختی سازه صورت گرفته بود، اما این تیم نهایتاً توانست آن را عملیاتی کند. برای اولین بار، عملکرد فوقالعادۀ آنها در مقیاسی چشمگیر باعث شد تأثیر عملی این مدل را در کشف مولکولی به کمک رایانه ببینیم.
این کار از این جهت نیز جالب است که در نهایت میتواند الگوی جدیدی را در برنامهریزی ساخت به کمک رایانه ایجاد کند. این مدل میتواند الهامبخش بسیاری از تحقیقات آینده در این زمینه باشد.»
روشن است که فرایند کشف دارو با ارائه مولکول های جدید، چه میزان میتواند در درمان بیماریها مؤثر باشد. شناسایی مولکولها و محدودسازی آنها بر اساس خواصشان، عملکردهایی است که با این مدل یادگیری ماشینی در بهینهسازی استفاده از مولکولها اتفاق میافتد.
انواع کاربردهای هوش مصنوعی در صنایع مختلف را در هوشیو بخوانید